NộI Dung
Các phần khácTrong hóa học, điện tử hóa trị là các electron nằm ở lớp vỏ electron ngoài cùng của nguyên tố. Biết cách tìm số electron hóa trị trong một nguyên tử cụ thể là một kỹ năng quan trọng đối với các nhà hóa học vì thông tin này xác định các loại liên kết hóa học mà nó có thể hình thành và do đó, khả năng phản ứng của nguyên tố. May mắn thay, tất cả những gì bạn cần để tìm các electron hóa trị của một nguyên tố là một bảng tuần hoàn tiêu chuẩn của các nguyên tố.
Các bước
Phần 1/2: Tìm các điện tử hóa trị bằng bảng tuần hoàn
Kim loại không chuyển tiếp
Tìm một bảng tuần hoàn các nguyên tố. Đây là một bảng mã màu được tạo thành từ nhiều ô vuông khác nhau liệt kê tất cả các nguyên tố hóa học mà loài người biết đến. Bảng tuần hoàn tiết lộ nhiều thông tin về các nguyên tố - chúng tôi sẽ sử dụng một số thông tin này để xác định số electron hóa trị trong nguyên tử mà chúng tôi đang nghiên cứu. Bạn thường có thể tìm thấy những thứ này bên trong bìa sách giáo khoa hóa học. Ngoài ra còn có một bảng tương tác tuyệt vời có sẵn trực tuyến ở đây.

Dán nhãn cho mỗi cột trên bảng tuần hoàn các nguyên tố từ 1 đến 18. Nói chung, trong bảng tuần hoàn, tất cả các nguyên tố trong một cột dọc sẽ có cùng số electron hóa trị. Nếu bảng tuần hoàn của bạn chưa đánh số từng cột, hãy đánh số cho mỗi cột bắt đầu bằng 1 cho đầu ngoài cùng bên trái và 18 cho đầu ngoài cùng bên phải. Theo thuật ngữ khoa học, những cột này được gọi là phần tử "các nhóm."- Ví dụ: nếu chúng ta đang làm việc với một bảng tuần hoàn mà các nhóm không được đánh số, chúng ta sẽ viết 1 ở trên Hydro (H), 2 ở trên Beryllium (Be), v.v. cho đến khi viết 18 ở trên Helium (He) .

Tìm phần tử của bạn trên bảng. Bây giờ, hãy xác định vị trí nguyên tố mà bạn muốn tìm các electron hóa trị trên bảng. Bạn có thể làm điều này với ký hiệu hóa học của nó (các chữ cái trong mỗi hộp), số nguyên tử của nó (số ở trên cùng bên trái của mỗi hộp) hoặc bất kỳ phần thông tin nào khác có sẵn cho bạn trên bảng.- Ví dụ, chúng ta hãy tìm các electron hóa trị cho một nguyên tố rất phổ biến: cacbon (C). Nguyên tố này có số hiệu nguyên tử là 6. Nó nằm ở đầu nhóm 14. Trong bước tiếp theo, chúng ta sẽ tìm các electron hóa trị của nó.
- Trong tiểu mục này, chúng ta sẽ bỏ qua Kim loại chuyển tiếp, là những nguyên tố trong khối hình chữ nhật được tạo bởi Nhóm 3 đến 12. Những nguyên tố này hơi khác so với phần còn lại, vì vậy các bước trong tiểu mục này sẽ thắng ' t làm việc trên chúng. Xem cách giải quyết những vấn đề này trong phần phụ bên dưới.

Sử dụng số thứ tự của nhóm để xác định số electron hóa trị. Số nhóm của một kim loại không chuyển tiếp có thể được sử dụng để tìm số electron hóa trị trong nguyên tử của nguyên tố đó. Các một số vị trí của nhóm là số electron hóa trị trong nguyên tử của các nguyên tố này. Nói cách khác:- Nhóm 1: 1 electron hóa trị
- Nhóm 2: 2 electron hóa trị
- Nhóm 13: 3 electron hóa trị
- Nhóm 14: 4 electron hóa trị
- Nhóm 15: 5 electron hóa trị
- Nhóm 16: 6 electron hóa trị
- Nhóm 17: 7 electron hóa trị
- Nhóm 18: 8 electron hóa trị (trừ heli, có 2)
- Trong ví dụ của chúng tôi, vì cacbon nằm trong nhóm 14, chúng ta có thể nói rằng một nguyên tử cacbon có bốn electron hóa trị.
Kim loại chuyển tiếp
Tìm một phần tử từ Nhóm 3 đến Nhóm 12. Như đã lưu ý ở trên, các nguyên tố từ nhóm 3 đến nhóm 12 được gọi là "kim loại chuyển tiếp" và hoạt động khác với các nguyên tố còn lại khi nói đến các điện tử hóa trị. Trong phần này, chúng tôi sẽ giải thích cách, ở một mức độ nhất định, thường không thể gán các electron hóa trị cho các nguyên tử này.
- Ví dụ: hãy chọn Tantali (Ta), nguyên tố 73. Trong vài bước tiếp theo, chúng tôi sẽ tìm thấy các điện tử hóa trị của nó (hoặc, ít nhất, thử đến.)
- Lưu ý rằng các kim loại chuyển tiếp bao gồm dãy lantan và actinide (còn được gọi là "kim loại đất hiếm") - hai hàng nguyên tố thường được đặt bên dưới phần còn lại của bảng bắt đầu bằng lantan và actini. Các yếu tố này đều thuộc về nhóm 3 của bảng tuần hoàn.
Hiểu rằng các kim loại chuyển tiếp không có các điện tử hóa trị "truyền thống". Việc hiểu tại sao các kim loại chuyển tiếp không thực sự "hoạt động" như phần còn lại của bảng tuần hoàn đòi hỏi một chút giải thích về cách các electron hoạt động trong nguyên tử. Xem bên dưới để biết sơ qua hoặc bỏ qua bước này để đến ngay câu trả lời.
- Khi các điện tử được thêm vào nguyên tử, chúng được sắp xếp thành các "quỹ đạo" khác nhau - về cơ bản là các khu vực khác nhau xung quanh hạt nhân mà các điện tử tập hợp lại. Nói chung, các điện tử hóa trị là các điện tử ở lớp vỏ ngoài cùng - nói cách khác, các điện tử cuối cùng được thêm vào .
- Vì những lý do hơi quá phức tạp để giải thích ở đây, khi các electron được thêm vào lớp ngoài cùng d vỏ của một kim loại chuyển tiếp (thêm về điều này bên dưới), các điện tử đầu tiên đi vào vỏ có xu hướng hoạt động như các điện tử hóa trị bình thường, nhưng sau đó, chúng không hoạt động và các điện tử từ các lớp quỹ đạo khác đôi khi hoạt động như các điện tử hóa trị thay thế. Điều này có nghĩa là một nguyên tử có thể có nhiều số electron hóa trị tùy thuộc vào cách nó được điều khiển.
Xác định số electron hóa trị dựa vào số thứ tự của nhóm. Một lần nữa, số nhóm của nguyên tố bạn đang kiểm tra có thể cho bạn biết các electron hóa trị của nó. Tuy nhiên, đối với các kim loại chuyển tiếp, không có một khuôn mẫu nào bạn có thể làm theo - số nhóm thường sẽ tương ứng với một loạt các số electron hóa trị có thể có. Đó là:
- Nhóm 3: 3 electron hóa trị
- Nhóm 4: 2 đến 4 electron hóa trị
- Nhóm 5: 2 đến 5 electron hóa trị
- Nhóm 6: 2 đến 6 electron hóa trị
- Nhóm 7: 2 đến 7 electron hóa trị
- Nhóm 8: 2 hoặc 3 electron hóa trị
- Nhóm 9: 2 hoặc 3 electron hóa trị
- Nhóm 10: 2 hoặc 3 electron hóa trị
- Nhóm 11: 1 hoặc 2 electron hóa trị
- Nhóm 12: 2 electron hóa trị
- Trong ví dụ của chúng tôi, vì Tantali nằm trong nhóm 5, chúng tôi có thể nói rằng nó có giữa điện tử hóa trị hai và năm, tuỳ thuộc vào tình hình.
Phần 2/2: Tìm các điện tử hóa trị với cấu hình điện tử
Học cách đọc cấu hình electron. Một cách khác để tìm các electron hóa trị của một nguyên tố là sử dụng một thứ gọi là cấu hình electron. Những thứ này thoạt nhìn có vẻ phức tạp, nhưng chúng chỉ là một cách để biểu diễn các obitan electron trong nguyên tử bằng các chữ cái và số và chúng sẽ dễ dàng khi bạn biết mình đang nhìn gì.
- Hãy xem xét một cấu hình ví dụ cho nguyên tố natri (Na):
- 1s2s2p3s
- Lưu ý rằng cấu hình electron này chỉ là một chuỗi lặp lại như sau:
- (số) (thư) (số) (thư) ...
- ...và như thế. Các (số) (chữ cái) chunk là tên của quỹ đạo electron và số lượng electron trong quỹ đạo đó - chỉ có vậy!
- Vì vậy, ví dụ của chúng tôi, chúng tôi sẽ nói rằng natri có 2 electron trong quỹ đạo 1s thêm 2 electron trong quỹ đạo 2s thêm 6 electron trong quỹ đạo 2p thêm 1 electron ở obitan 3s. Đó là tổng số 11 electron - natri là nguyên tố số 11, vì vậy điều này có ý nghĩa.
- Hãy nhớ rằng mỗi vỏ con có một dung lượng electron nhất định. Dung lượng electron của chúng như sau:
- s: công suất 2 electron
- p: công suất 6 electron
- d: công suất 10 electron
- dung lượng điện tử f: 14
- Hãy xem xét một cấu hình ví dụ cho nguyên tố natri (Na):
Tìm cấu hình electron của nguyên tố bạn đang kiểm tra. Khi bạn đã biết cấu hình electron của một nguyên tố, việc tìm số electron hóa trị của nó khá đơn giản (tất nhiên là đối với các kim loại chuyển tiếp.) Nếu bạn đã cung cấp cấu hình ngay từ đầu, bạn có thể chuyển sang bước tiếp theo. Nếu bạn phải tự tìm, hãy xem bên dưới:
- Kiểm tra cấu hình electron đầy đủ của oganesson (Og), nguyên tố 118, là nguyên tố cuối cùng trong bảng tuần hoàn. Nó có nhiều electron nhất so với bất kỳ nguyên tố nào, vì vậy cấu hình electron của nó thể hiện tất cả các khả năng bạn có thể gặp ở các nguyên tố khác:
- 1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d7p
- Bây giờ bạn đã có cái này, tất cả những gì bạn cần làm để tìm cấu hình electron của một nguyên tử khác là chỉ cần điền vào mẫu này từ đầu cho đến khi bạn hết electron. Điều này dễ dàng hơn so với âm thanh. Ví dụ, nếu chúng ta muốn lập sơ đồ quỹ đạo cho clo (Cl), nguyên tố 17, có 17 electron, chúng ta sẽ làm như sau:
- 1s2s2p3s3p
- Nhận thấy rằng số electron cộng lại lên tới 17: 2 + 2 + 6 + 2 + 5 = 17. Bạn chỉ cần thay đổi số ở quỹ đạo cuối cùng - phần còn lại là như nhau vì các obitan trước quỹ đạo cuối cùng là hoàn toàn. .
- Để biết thêm về cấu hình electron, hãy xem thêm bài viết này.
- Kiểm tra cấu hình electron đầy đủ của oganesson (Og), nguyên tố 118, là nguyên tố cuối cùng trong bảng tuần hoàn. Nó có nhiều electron nhất so với bất kỳ nguyên tố nào, vì vậy cấu hình electron của nó thể hiện tất cả các khả năng bạn có thể gặp ở các nguyên tố khác:
Gán các electron vào vỏ quỹ đạo bằng Quy tắc Octet. Khi các electron được thêm vào nguyên tử, chúng rơi vào các obitan khác nhau theo thứ tự đã cho ở trên - hai obitan đầu tiên đi vào quỹ đạo 1s, hai electron sau đó đi vào quỹ đạo 2s, sáu sau đó đi vào quỹ đạo 2p, và Sớm. Khi xử lý các nguyên tử bên ngoài các kim loại chuyển tiếp, chúng ta nói rằng các obitan này tạo thành "vỏ quỹ đạo" xung quanh hạt nhân, với mỗi vỏ kế tiếp sẽ xa hơn so với các vỏ trước đó. Bên cạnh lớp vỏ đầu tiên, chỉ có thể chứa hai điện tử, mỗi lớp vỏ có thể có tám điện tử (ngoại trừ, một lần nữa, khi xử lý các kim loại chuyển tiếp.) Đây được gọi là Quy tắc bát tử.
- Ví dụ: giả sử chúng ta đang xem xét nguyên tố Boron (B). Vì số hiệu nguyên tử của nó là năm nên chúng ta biết nó có năm electron và cấu hình electron của nó trông như sau: 1s2s2p. Vì vỏ quỹ đạo thứ nhất chỉ có hai điện tử, chúng ta biết rằng Boron có hai lớp vỏ: một với hai điện tử 1s và một có ba điện tử từ các obitan 2s và 2p.
- Ví dụ khác, một nguyên tố như clo (1s2s2p3s3p) sẽ có ba lớp vỏ quỹ đạo: một lớp có hai electron 1s, một lớp có hai electron 2s và sáu electron 2p, và một lớp có hai electron 3s và năm electron 3p.
Tìm số electron ở lớp vỏ ngoài cùng. Giờ bạn đã biết lớp vỏ electron của nguyên tố, việc tìm kiếm các electron hóa trị rất dễ dàng: chỉ cần sử dụng số electron ở lớp vỏ ngoài cùng. Nếu lớp vỏ bên ngoài đầy (nói cách khác, nếu nó có tám electron hoặc, đối với lớp vỏ thứ nhất là hai), nguyên tố này trơ và sẽ không dễ phản ứng với các nguyên tố khác. Tuy nhiên, một lần nữa, mọi thứ không hoàn toàn tuân theo các quy tắc này đối với kim loại chuyển tiếp.
- Ví dụ: nếu chúng ta đang làm việc với Boron, vì có ba electron trong lớp vỏ thứ hai, chúng ta có thể nói rằng Boron có số ba các electron hóa trị.
Sử dụng các hàng của bảng làm phím tắt vỏ quỹ đạo. Các hàng ngang của bảng tuần hoàn được gọi là nguyên tố "Chu kỳ." Bắt đầu từ đầu bảng, mỗi khoảng thời gian tương ứng với số vỏ điện tử các nguyên tử trong khoảng thời gian sở hữu. Bạn có thể sử dụng điều này như một phím tắt để xác định một nguyên tố có bao nhiêu electron hóa trị - chỉ cần bắt đầu từ phía bên trái của chu kỳ khi đếm electron. Một lần nữa, bạn sẽ muốn bỏ qua các kim loại chuyển tiếp bằng phương pháp này, bao gồm các nhóm 3-12.
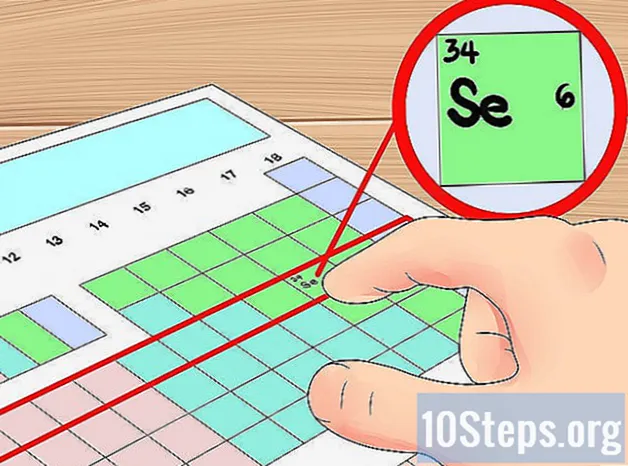
- Ví dụ, chúng ta biết nguyên tố selen có bốn vỏ quỹ đạo vì nó ở chu kỳ thứ tư. Vì nó là nguyên tố thứ sáu tính từ bên trái trong chu kỳ thứ tư (bỏ qua các kim loại chuyển tiếp), chúng ta biết rằng lớp vỏ thứ tư ngoài cùng có sáu điện tử, và do đó, Selen có sáu electron hóa trị.
Câu hỏi và câu trả lời của cộng đồng
Làm thế nào để chúng ta tính toán electron hóa trị?
Các điện tử hóa trị có thể được tìm thấy bằng cách xác định cấu hình điện tử của các nguyên tố. Sau đó số electron ở lớp vỏ ngoài cùng bằng tổng số electron hóa trị của nguyên tố đó.
Nếu một nguyên tử có 33 electron thì có bao nhiêu electron hóa trị?
Nếu nguyên tử không phải là ion, thì chúng ta có thể nói rằng nguyên tử có 33 proton. Điều này có nghĩa nó là nguyên tố 33, là asen. Khi đó ta biết rằng nó không phải là kim loại chuyển tiếp nên ta tìm và tìm chữ số hàng đơn vị trong nhóm của nó là 5, tức là nó có 5 electron hóa trị.
Làm cách nào để xác định số nguyên tử của heli?
Số proton bằng số nguyên tử.
Tại sao các electron thu được điện tích âm mà không phải điện tích dương?
Nguyên tử tăng hoặc mất electron, điện tích âm, do proton mang điện tích dương và chúng bị giữ trong hạt nhân bởi lực hạt nhân mạnh. Đây là một trong bốn lực riêng biệt trong Vũ trụ: lực hấp dẫn, lực điện từ, lực yếu và lực hạt nhân mạnh. Nó phải mạnh bởi vì các proton đẩy nhau nhưng chúng thực sự ở gần nhau trong hạt nhân (cùng với neutron, cũng được giữ bởi lực mạnh.) Ý tưởng là lực mạnh là cực kỳ mạnh nhưng chỉ trong khoảng cách rất nhỏ. Hãy nghĩ đến những cái móc siêu mạnh. Để kết nối proton và neutron, bạn cần những lực như lực hấp dẫn cực lớn của một ngôi sao, một siêu tân tinh hoặc vụ nổ hạt nhân.
Electron hóa trị của khí quý là gì?
Khí cao quý có tám electron hóa trị - trạng thái ổn định nhất đối với một nguyên tố.
Tại sao nitơ có 6 electron hóa trị nhưng nó lại ở nhóm 15?
Nitơ chỉ có năm điện tử hóa trị vì nó ở nhóm 5, mặc dù thực sự ở nhóm 15 bạn sẽ bỏ qua các kim loại chuyển tiếp vì các nhóm này có cách xác định điện tử hóa trị khác nhau. Do đó: nhóm 13 có nghĩa là nhóm 3, v.v.
Một nguyên tử có 7 proton, 8 nơron và 7 electron. Số electron trong lớp vỏ hóa trị của nó là bao nhiêu?
Nguyên tố có chứa 7 proton là Nitơ. Nitơ nằm trong cột nguyên tố có 5 electron ở lớp vỏ hóa trị. Số lượng nơtron không liên quan đến việc tìm số electron hóa trị trong một nguyên tố cụ thể.
Các nguyên tử có 7 electron lớp vỏ ngoài cùng nằm ở vị trí nào trên Bảng tuần hoàn?
Nhìn từ cột thứ hai đến cột cuối cùng ở phía bên tay phải, bên cạnh các khí trơ.
Electron hóa trị là gì?
Điện tử hóa trị là một điện tử được tìm thấy ở phần ngoài cùng của nguyên tử và có thể được chia sẻ hoặc nhận trong một phản ứng.
Tại sao các nguyên tố trong bảng tuần hoàn có số electron hóa trị khác nhau?
Chúng có cấu trúc hóa học khác nhau. Các electron hóa trị là thứ tạo ra phản ứng hóa học.
Lời khuyên
- Lưu ý rằng cấu hình electron có thể được viết theo kiểu viết tắt bằng cách sử dụng khí quý (các nguyên tố trong nhóm 18) để thay thế cho các obitan khi bắt đầu cấu hình. Ví dụ: cấu hình electron của natri có thể được viết là 3s1 - về cơ bản, nó giống như neon, nhưng có thêm một electron trong quỹ đạo 3s.
- Các kim loại chuyển tiếp có thể có vỏ phụ hóa trị không được lấp đầy hoàn toàn. Việc xác định số electron hóa trị chính xác trong các kim loại chuyển tiếp liên quan đến các nguyên tắc của lý thuyết lượng tử nằm ngoài phạm vi của bài viết này.
- Xin lưu ý rằng các bảng tuần hoàn khác nhau giữa các quốc gia. Vì vậy, vui lòng kiểm tra xem bạn đang sử dụng đúng, đã cập nhật để tránh nhầm lẫn.
- Đảm bảo biết khi nào thì cộng hoặc trừ quỹ đạo cuối cùng để tìm các electron hóa trị.
Những thứ bạn sẽ cần
- Bảng tuần hoàn các nguyên tố
- Bút chì
- Giấy
Mỗi ngày tại wikiHow, chúng tôi làm việc chăm chỉ để cung cấp cho bạn quyền truy cập vào các hướng dẫn và thông tin sẽ giúp bạn có cuộc sống tốt hơn, cho dù điều đó giúp bạn an toàn hơn, khỏe mạnh hơn hay cải thiện sức khỏe của bạn. Trong bối cảnh khủng hoảng kinh tế và sức khỏe cộng đồng hiện nay, khi thế giới đang chuyển mình mạnh mẽ và tất cả chúng ta đang học hỏi và thích nghi với những thay đổi trong cuộc sống hàng ngày, mọi người cần wikiHow hơn bao giờ hết. Sự ủng hộ của bạn giúp wikiHow tạo ra nhiều bài báo và video minh họa chuyên sâu hơn và chia sẻ thương hiệu đáng tin cậy của chúng tôi về nội dung hướng dẫn với hàng triệu người trên khắp thế giới. Hãy cân nhắc đóng góp cho wikiHow hôm nay.